Руководитель

Кадровый состав
Петрова Ольга Витальевна – к.х.н., с.н.с.
Гоцко Максим Дмитриевич – к.х.н., в.н.с.
Сагитова Елена Фаритовна – к.х.н., с.н.с.
Щербакова Виктория Сергеевна – к.х.н., с.н.с.
Мартыновская Светлана Валерьевна – к.х.н., с.н.с.
Салий Иван Владимирович – к.х.н., с.н.с.
Будаев Арсалан Бадмаевич – к.х.н., н.с.
Гыргенова Елена Андреевна – м.н.с.
Степанова Софья Александровна – лаборант.
Макаренко Даниил Алексеевич - лаборант.
Царенков Максим Владимирович – лаборант.

Основное направление исследований
Группа развивает химию функционализированных пирролов – важнейших прекурсоров и интермедиатов прогрессивных лекарственных средств, оптоэлектронных материалов для солнечных батарей, сверхчувствительных сенсоров и цифровых технологий. В основе исследований лежит открытая в группе реакция кросс-сочетания пирролов с галогенацетиленами, протекающая, в отличие от реакции Соганаширы, без участия палладия и других переходных металлов, без растворителя и при комнатной температуре. В отличие от классических вариантов кросс-сочетания она позволяет вводить в нефункционализированное пиррольное кольцо ацетиленовые фрагменты с сильными электроноакцепторными заместителями. Это достигается проведением реакции в твердых средах, в качестве которых используются различные оксиды и соли металлов. Несмотря на очевидные препаративные преимущества и концептуальную новизну такого подхода, он все еще сравнительно редко применяется для решения конкретных синтетических задач. Ещё одним направлением исследования является развитие направленного дизайна аннелированных гетероциклических ансамблей с комплексом полезных свойств на основе одного класса строительных блоков – N-алленилпиррол-2-карбальдегидов – реакциями с различными нуклеофилами и бинуклеофилами.
Основные научные результаты (фундаментальные исследования)
1. Беспалладиевое кросс-сочетание пирролов и фуранов с галогенацетиленами
Открытая в группе реакция кросс-сочетания пирролов с галогенацетиленами в среде твердых оксидов и солей металлов, приводящая к 2-этинилпирролам (высокоэффективная альтернатива реакции Сонагаширы) осуществляется не только без палладия и меди, но и в отсутствии растворителя и основания.
На примере природного соединения – ментофурана - показано, что фураны также способны к кросс-сочетанию с галогенацетиленами в аналогичных условиях с образованием ацетиленовых производных.
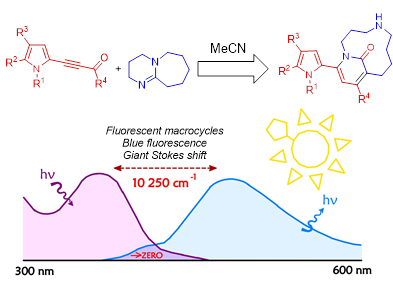
2. Макроциклические мостиковые диазакетоны из DBU и пирролилацетиленовых кетонов - новый класс водорастворимых флуорофоров
Обнаружен ранее неизвестный класс флуорофоров, представляющих собой 14-членные мостиковые гетероциклы, пирролил-диазабицикло[8.3.1]тетрадекадиеноны, на основе реакции 2-ацилэтинилпирролов и широко доступного органического основания DBU. Новые флуорофоры характеризуются яркой флуоресценцией в сине-зелёной области, гигантскими Стоксовыми сдвигами с практически нулевым перекрыванием полос поглощения и эмиссии.
Trofimov B.A., Sobenina L.N., Petrova O.V., Sagitova E.F., Petrushenko K.B., Tomilin D.N., Martyanova E.G., Razumov V.F., Oparina L.A., Ushakov I.A., Korchagin D.V., Belogolova A.M., Trofimov A.B. Macrocyclic bridgehead fluorophores, pyrrolyl-diazabicyclo [8.3.1]-tetradecadienones, with giant stokes shifts // Journal of organic chemistry.– 2024.– 89.– 24.– 18142–18158. DOI: 10.1021/acs.joc.4c02002
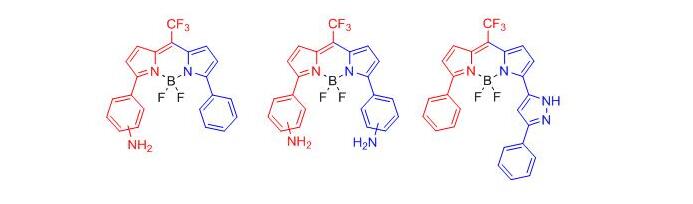
3. Высокочувствительные флуоресцентные сенсоры – бородиазаиндацены (BODIPY)
Разработаны высокочувствительные переключаемые сенсоры для неводных сред на слабые изменения рН среды и присутствие СО2 и формальдегида. Синтез основан на конденсации трифторметилпирролилэтанолов с пирролами и BF3 в присутствии кислоты и окислителя.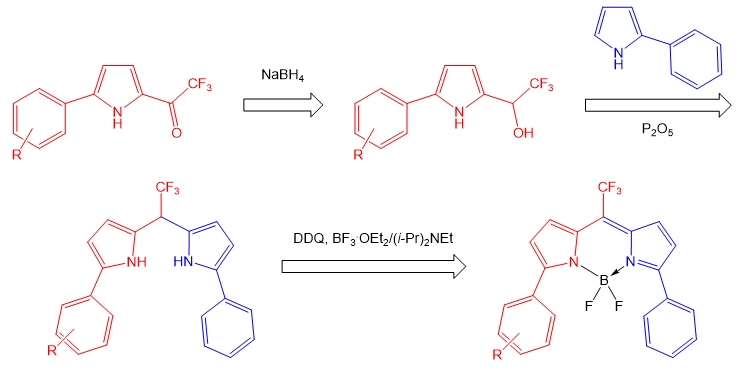
Sobenina L.N., Vasil'tsov A.M., Petrova O.V., Petrushenko K.B., Ushakov I.A., Clavier G., Meallet-Renault R., Mikhaleva A.I., Trofimov B.A. A General Route to Symmetric and Asymmetric meso-CF3-3(5)-Aryl(Hetaryl)- and 3,5-Diaryl(Dihetaryl)-BODIPY Dyes // Org. Lett. – 2011. – V. 13. – P. 2524-2527. DOI: 10.1021/ol200360f.
Hu D., Zhang T., Li S., Yu T., Zhang X., Hu R., Feng J., Wang S., Liang T., Chen J., Sobenina L.N., Trofimov B.A., Li Y., Ma J., Yang G. Ultrasensitive reversible chromophore reaction of BODIPY functions as high ratio double turn on probe // Nature Commun. - 2018. - V. 9, N 1. – 362. DOI: 10.1038/s41467-017-02270-0.
Gadomska A.V., Nevidimov A.V., Tovstun S.A., Petrova O.V., Sobenina L.N., Trofimov B.A., Razumov V.F. Fluorescence from 3,5-diphenyl-8-CF3-BODIPYs with amino substituents on the phenyl rings: Quenching by aromatic molecules / Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. – 2021. V. 254. – P. 119632. DO I: 10.1016/j.saa.2021.119632.
Trukhan I.S., Tomilin D.N., Dremina N.N., Sobenina L.N., Shurygin M.G., Petrushenko K.B., Petrushenko I.K., Trofimov B.A., Shurygina I.A. Application of meso-CF3-fluorophore BODIPY with phenyl and pyrazolyl substituents for lifetime visualization of lysosomes // Molecules. – 2022. – V. 27. – Iss. 15. – P. 5018 (1-19). DOI: 10.3390/molecules27155018.
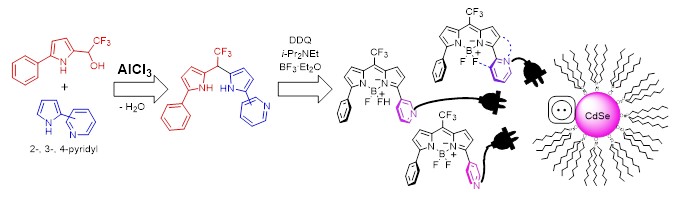
4. Ранее неизвестные ассиметричные пиридиновые бородиазаиндацены (BODIPY), усовершенствованная сборка и абсорбция на CdSe квантовых точках
Существенно улучшена ключевая стадия синтеза асимметричных флуорофоров BODIPY – сборка дипиррометанов – путем использования нового высокоэффективного катализатора AlCl3. Модифицированная стратегия открывает подходы к мезо-фторированным флуорофорам BODIPY c пиридиновыми заместителями.
Обнаруженная абсорбция на CdSe-квантовых точках перспективна для разработки флуоресцентных меток и хемосенсоров.
Elena G. Martyanova, Timofey P. Martyanov, Denis N. Tomilin, Igor A. Ushakov, Denis V. Korchagin, Maxim G. Spirin, Vladimir F. Razumov, Lyubov N. Sobenina and Boris A. Trofimov Pyridyl-BODIPY dyes: synthesis, optical properties and adsorption on CdSe quantum dots // New J. Chem., 2024,48, 15036-15044 DOI: 10.1039/D4NJ02588A
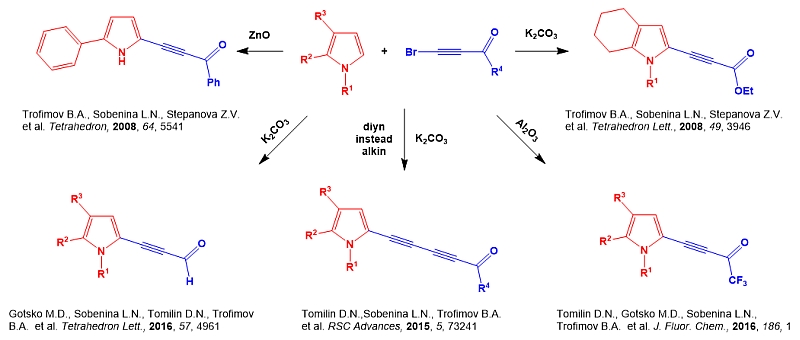
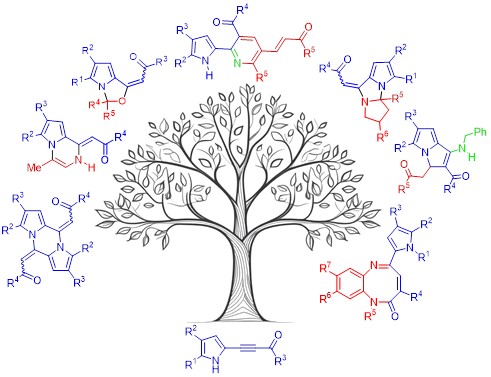
5. Синтез ранее неизвестных гетероциклических ансамблей и конденсированных соединений на платформе 2-ацилэтинилпирролов
На основе реакций ставших легко доступными 2-ацилэтинилпирролов с С-нуклеофилами (ацетонитрил, малононитрил, метиленоактивные эфиры и амиды, тозилметилизоцианид) разработаны новые, эффективные методы синтеза ранее неизвестных пирролсодержащих гетероциклических ансамблей – пирролил-пиридинов, пирролил-дицианоанилинов, пирролил-пиронов, пирролил-аминопиронов, пирролил-пиридонов, и бипирролов, а также функционализированных ацильными и тозильной группами С-винилпирролов и тозилпирролил-1,3-енинов.
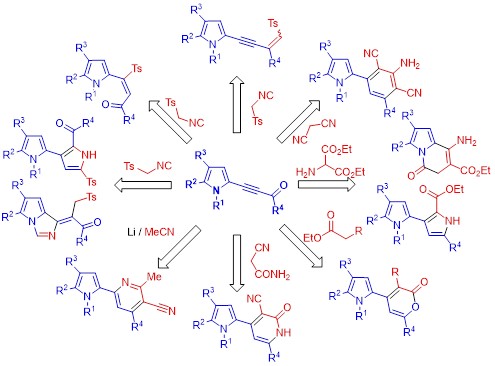
Gotsko, M.D., Saliy, I.V., Ushakov, I.A., Sobenina, L.N., Trofimov, B.A. Functionalized 2,3′-Bipyrroles and Pyrrolo[1,2-c]imidazoles from Acylethynylpyrroles and Tosylmethylisocyanide // Molecules 2024. – 29. – 885. DOI: 10.3390/molecules29040885D.
Gotsko, I. V. Saliy, I. A. Ushakov, L. N. Sobenina, B. A. Trofimov, One-pot synthesis of functionalized dihydroindolizinones from pyrrolylpropynoates and diethyl aminomalonate // Mendeleev Commun. – 2025. – 35. –1. – 99. DOI: 10.71267/mencom.7547
Gotsko M.D., Saliy I.V., Sobenina L.N., Ushakov I.A., Trofimov B.A. From acylethynylpyrroles to pyrrole-pyrone ensembles in a one step // Tetrahedron Letters. – 2019. – V. 60. – № 151126., DOI: 10.1016/j.tetlet.2019.151126.
Saliy I.V., Gotsko M.D., Sobenina L.N., Ushakov I.A., Trofimov B.A. Bio-inspired functionalized pyrrole-pyridone ensembles: synthesis on the platform of acylethynylpyrroles // Synthesis. – 2020. – V. 52. – N. 18. – P. 2698-2704. DOI: 10.1055/s-0040-1707148.
Saliy I.V., Gotsko M.D., Sobenina L.N., Ushakov I.A., Trofimov B.A. Chemo- and stereoselective synthesis of E-2-(2-acyl-1-tosylvinyl)pyrroles from tosylmethyl isocyanide (TosMIC) and 2-(acylethynyl)pyrroles // Tetrahedron Letters. – 2021. – V. 84. – № 153432. DOI: 10.1016/j.tetlet.2021.153432.
Trofimov B.A., Gotsko M.D., Saliy I.V., Sobenina L.N., , Ushakov I.A., Kireeva V.V. Functionalized Bipyrroles and Pyrrolyl-Aminopyrones from Acylethynylpyrroles and Diethyl Aminomalonate. // Synthesis. – 2021. – V. 54. –– P. 1134-1144. DOI:10.1055/a-1681-4164.
Gotsko M.D., Saliy, I.V., Ushakov I.A., Sobenina L.N.,, Trofimov B.A. Substituent-Dependent Divergent Synthesis of 2-(3-Amino-2,4-dicyanophenyl)pyrroles, Pyrrolyldienols and 3-Amino-1-acylethylidene-2-cyanopyrrolizines via Reaction of Acylethynylpyrroles with Malononitrile // Molecules. – 2022. –V. 27. – №. 8528. DOI: 10.3390/molecules27238528.
Tomilin D.N., Sobenina L.N., Saliy I.V., Ushakov I.A., Belogolova A.M., Trofimov B.A. Substituted pyrrolyl-cyanopyridines on the platform of acylethynylpyrroles via their 1 : 2 annulation with acetonitrile under the action of lithium metal // New Journal of Chemistry. – 2022. – V. 46. – N. 27. – P. 13149-13155. DOI: 10.1039/D2NJ02011D.
Gotsko M.D., Saliy I.V., Sobenina L.N., Ushakov I.A., Trofimov B.A. Tosyl/pyrrolyl-capped 1,3-enynes via t-BuOK-assisted reaction of TosMIC with acylethynylpyrroles: a new feature of this popular reagent // New Journal of Chemistry. – 2022. – V. 46. – N. 35. – P. 16646-16650. DOI: 10.1039/D2NJ02827A.
На основе реакции 2-ацилэтинилпирролов с N-нуклеофилами разработаны эффективные методы синтеза функционализированных линейно связанных и конденсированных пиррольных систем, таких как бипирролы, пирролил-пиридины, пирролил-пиразолы, пирролил-изоксазолы, пирролил-имидазолины, пирролопиразины, пирролизины и пирролоксазолы. Ряд синтезированных пиррольных структур проявляют значительную ингибирующую активность ферментов ацетилхолинэстеразы и α-гликозидазы, что делает их кандидатами в противодиабетические препараты и препараты для лечения болезни Альцгеймера.
Sobenina L.N., Tomilin D.N., Sagitova E.F., Ushakov I.A., Trofimov B.A. Transition metal-free, atom- and step-economic synthesis of aminoketopyrrolizines from benzylamine, acylethynylpyrroles and acylacetylenes // Org. Lett. – 2017. – V. 19, No 7. – P. 1586-1589. DOI: 10.1021/acs.orglett.7b00408.
Sobenina L.N., Sagitova E.F., Ushakov I.A., Trofimov B.A. Transition-metal-free synthesis of pyrrolo[1,2-a]pyrazines via intramolecular cyclization of N-propargyl(pyrrolyl)enaminones // Synthesis. – 2017. – V. 49, No 17. – P. 4065-4081. Имп. Факт. 2.650. DOI: 10.1055/s-0036-1588454.
Tomilin D. N., Sobenina L. N., Ushakov I. A., Trofimov B. A. Highly functionalized pyrrolylpyridines from 2-(acylethynyl)pyrroles // Synthesis. – 2021. – V. 53. – Iss. 6. – P. 1137-1148. DOI: 10.1055/s-0040-1706474.
6. Ранее неизвестные флуорофоры семейства BODIPY с мезо-CF3 и ацетиленовыми заместителями в положениях 3(5) борадиазаиндаценового ядра на основе легко доступных 5-арил-2-трифторацетилпирролов.
Разработана общая стратегия направленного синтеза флуорофоров семейства BODIPY с улучшенными оптическими характеристиками на основе 5-арил-2-трифторацетилпирролов. Стратегия основана на введении ацилэтинильных заместителей в молекулу мезо-СF3-дипирролилметанов (продуктов кислотно-катализируемой конденсации трифтор-1-(5-арилпиррол-2-ил)этанолов с пирролом) с дальнейшей трансформацией ацилэтинильных фрагментов в гетероциклические, и превращении в соответствующие флуорофоры семейства BODIPY. Эта стратегия открывает дополнительные перспективы для дизайна сверхчувствительных сенсоров для использования в нанотехнологиях, в оптоэлектронике и в биологических исследованиях. В частности, создан селективный высокостабильный флуоресцентный детектор лизосом в живых клетках, превосходящий по свойствам коммерчески-доступные аналоги.
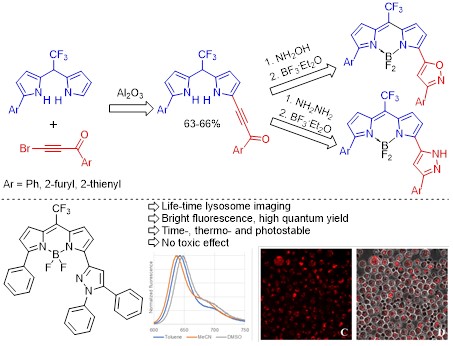
Tomilin D.N., Sobenina L.N., Petrushenko K.B., Ushakov I.A., Trofimov B.A Design of novel meso-CF3-BODIPY dyes with isoxazole substituents // Dyes and Pigments. – 2018. – V. 152. – P. 14-18. DOI: 10.1016/j.dyepig.2018.01.026.
Trukhan I.S., Tomilin D.N., Dremina N.N., Sobenina L.N., Shurygin M.G., Petrushenko K.B., Petrushenko I.K., Trofimov B.A., Shurygina I.A. Application of meso-CF3-fluorophore BODIPY with phenyl and pyrazolyl substituents for lifetime visualization of lysosomes // Molecules. – 2022. – V. 27. – Iss. 15. – P. 5018 (1-19). DOI: 10.3390/molecules27155018.
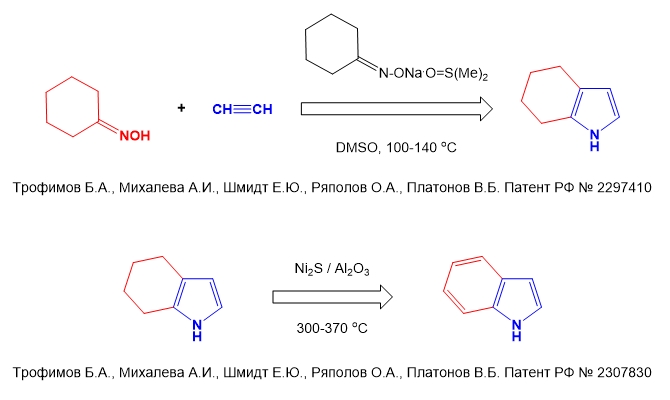
7. Промышленно-ориентированная технология синтеза 4,5,6,7-тетерагидроиндола и индола из циклогексаноноксима (планшет 3)
Разработаны ориентированные на промышленность технологии синтеза 4,5,6,7-тетрагидроиндола из циклогексаноноксима и ацетилена с использованием в качестве катализатора системы циклогексаноноксимат натрия/ДМСО и селективного метода дегидрирования 4,5,6,7-тетерагидроиндола в индол с использованием системы Ni2S/γ-Al2O3 в качестве катализатора (совместно с компанией Waldis, Литва).
8. Разработка метода получения перспективного класса строительных блоков – N-алленилпиррол-2-карбальдегидов
Разработан способ селективного получения ранее неизвестного класса N-алленилпиррол-2-карбальдегидов последовательным пропаргилированием замещенных NH-пирролов в суперосновной системе KOH/ДМСО и введением в полученные N-алленилпирролы формильной группы с помощью модифицированной реакции Вильсмайeра-Хаака. Полученные соединения являются перспективными строительными блоками для тонкого органического синтеза.
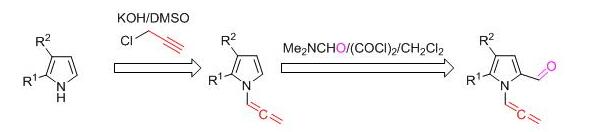
Martynovskaya S.V. , Shcherbakova V.S., Ushakov I.A., Borodina T.N., Ivanov A.V. / Expedient synthesis of a new class of organic building blocks: N-allenylpyrrole-2-carbaldehydes // Tetrahedron Letters. – 2020. – V. 61. – 152666. DOI: 10.1016/j.tetlet.2020.152666.
9. N-Алленилпиррол-2-карбальдегиды как универсальная платформа для создания широкой библиотеки новых аннелированных пирролсодержащих гетероциклических систем
Разработан метод хемо-, регио- и стереоселективного синтеза перспективных 3-метилпирроло[1,2-a]пиразин-2-оксидов путем простой реакции оксимирования N-алленилпиррол-2-карбальдегидов.
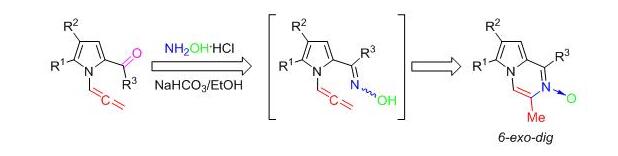
Ivanov A.V., Martynovskaya S.V., Shcherbakova V.S., Ushakov I.A., Borodina T.N., Bobkov Al.S, Vitkovskaya N.M. / Ambient access to a new family of pyrrole-fused pyrazine nitrones via 2-carbonyl-N-allenylpyrroles // Org. Chem. Front. – 2020. – V. 7. – P. 4019 – 4025. DOI: 10.1039/D0QO00762E.
Разработан простой и эффективный подход к созданию 6-метилбензо[4,5]имидазо[1,2-a]пирроло[2,1-c]пиразинов путем взаимодействия N-алленилпиррол-2-карбальдегидов с о-фенилендиамином. Помимо ожидаемого продукта в реакции образуется неожиданный 5a-метил-5a,6-дигидро-5H,12H-бензо[4,5]имидазо[1,2-a]пирроло[1,2-d]пиразин – продукт с альтернативным сочленением циклов.
Предложен альтернативный метод синтеза высококонденсированных гетероциклических систем – 5-метилбензо[4,5]имидазо[1,2-a]пирроло[2,1-c]пиразинов – путем взаимодействия NH-пирролилбензимидазолов с пропаргилхлоридом в суперосновной системе KOH/ДМСО.
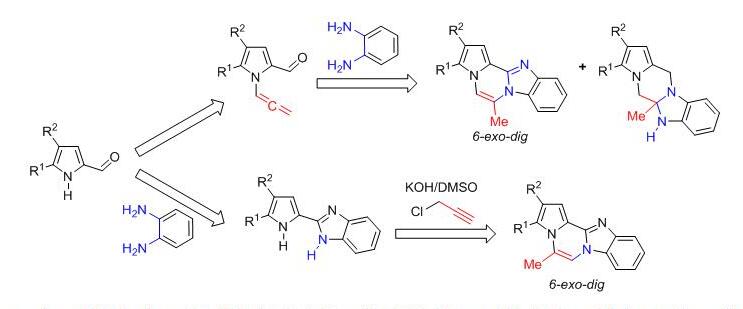
Martynovskaya S.V., Budaev A.B., Ushakov I.A., Borodina T.N., Ivanov A.V. / Solvent Moisture-Controlled Self-Assembly of Fused Benzoimidazopyrrolopyrazines with Different Ring’s Interposition // Molecules. – 2022. – V. 27. – 2460. DOI: 10.3390/molecules27082460.
Разработан одностадийный высокоселективный подход к синтезу ранее неизвестных ансамблей тетрагидродипирролодипиразинотетразинов из простых и доступных N-алленилпиррол-2-карбальдегидов и гидразинов. Полученные соединений оказались нестабильны в кислых условиях и образуют соответствующие соли N-аминопирролопиразина, последние в свою очередь в основных условиях обратно димеризуются до тетрагидродипирролодипиразинотетразинов. Обнаружена беспрецедентная обратимая димеризация полученного класса соединений, которая открывает практические возможности для разработки чувствительных к pH датчиков и переключателей широкого диапазона с помощью модификации пиррольного кольца.
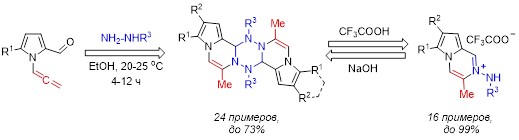
Martynovskaya S.V., Gyrgenova E.A., Ushakov I.A., Borodina T.N., Ivanov A.V. / Synthesis of Tetrazines from N-Allenylpyrrole-2-carbaldehydes and pH-Controlled Reversible Fragmentation // Organic Letters. – 2024. – V. 26, 132−136. DOI: 10.1021/acs.orglett.3c03751
10. Перспективные аннелированные 3-метил-1H-пирроло[2,1-c][1,4]оксазины
Изучены закономерности пропаргилирования 2-гидроксиметилпиррола – продукта восстановления NH-пирролкарбальдегида – в суперосновной системе KOH/ДМСО и установлено, что в зависимости от соотношения реагентов, степени разбавления и основности среды реакция может быть направлена на селективное образование одного из трех продуктов: N-алленилпирролил-2-метанола, N-алленил-2-[(пропаргилокси)метил]-1H-пиррола и 3-метил-1H-пирроло[2,1-с][1,4]оксазина.
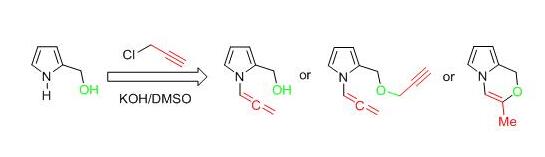
Vitkovskaya N.M., Bobkov A.S., Kuznetsova S.V., Shcherbakova V.S., Ivanov A.V. / Base-Promoted Formation of Annelated Pyrrolo-1,4-oxazine Ensemble from 1H-pyrrol-2-ylmethanol and Propargyl Chloride // ChemPlusChem. – 2020. – V.84. – P.88–100. DOI: 10.1002/cplu.201900407.
В случае замещенных 2-гидроксиметилпирролов в менее щелочных условия, но при более длительном времени, реакция протекает селективно с образованием единственного продукта – пирролооксазина.
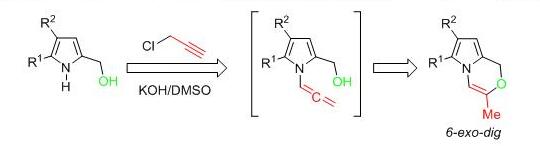
Vitkovskaya N.M., Bobkov A.S., Kuznetsova S.V., Shcherbakova V.S., Ivanov A.V. / Base-Promoted Formation of Annelated Pyrrolo-1,4-oxazine Ensemble from 1H-pyrrol-2-ylmethanol and Propargyl Chloride // ChemPlusChem. – 2020. – V.84. – P. 1 – 14. DOI: 10.1002/cplu.201900407.
Гранты, контракты, хоздоговора, партнеры по инновационным исследованиям за последние 3 года
Грант РНФ 21-73-10134 «Разработка общей однореакторной и атом-экономной методологии построения пирроло-имидазолидиновых структур на основе новой реакции циклоприсоединения пирролилацетиленов к двойной С=N связи» (руководитель д.х.н Беляева К.В.)
Грант РФФИ 20-33-90187 «С-Ацилэтинилпирролы в дизайне функционализированных пиррольных систем – перспективных лекарственных средств и их прекурсоров» (руководитель д.х.н. Л.Н. Собенина)
Грант РНФ 19-73-10063 «Пирролы с электронодефицитными ацетиленовыми заместителями как платформа для построения поляризованных дипиррометанов/дипиррометенов и борфторидных хелатных комплексов на их основе – новых флуорофоров и красителей медицинского назначения, прекурсоров антибактериальных и онкоориентированных лекарств, компонентов оптоэлектронных материалов» (руководитель к.х.н. Д.Н. Томилин)
Грант РФФИ-Государственный фонд естественных наук Китая 19-53-53008 «Создание новых флуоресцентных сенсоров типа BODIPY, обладающих повышенной чувствительностью к изменениям в биологических объектах и окружающей среде» (руководитель академик РАН Б.А. Трофимов)
Грант РФФИ 19-33-90051 «N-Алленилпиррол-2-карбальдегиды как универсальная платформа для создания широкой библиотеки новых аннелированных пирролсодержащих гетероциклических систем» (руководитель д.х.н Иванов А.В.)
Награды
Томилин Денис Николаевич – именная стипендия Фонда Стратегического и Инновационного Развития Иркутской Области, 2022 год
Щербакова Виктория Сергеевна – лауреат конкурса в сфере науки и техники 2022 года, диплом за разработку технологии получения востребованных виниловых эфиров путем утилизации хлорорганических отходов
Мартыновская Светлана Валерьевна – стипендия Губернатора Иркутской Области, 2019 год
Мартыновская Светлана Валерьевна – лауреат Конкурса проектов молодых ученых 2021 года, диплом 1 степени
Мартыновская Светлана Валерьевна – лауреат конкурса в сфере науки и техники 2022 года, диплом за разработку технологии получения востребованных виниловых эфиров путем утилизации хлорорганических отходов
Мартыновская Светлана Валерьевна – именная стипендия Фонда Стратегического и Инновационного Развития Иркутской Области, 2022 год
Гыргенова Елена Андреевна – диплом за лучший стендовый доклад на конференции «Фаворский 2023»
Гыргенова Елена Андреевна – именная стипендия Фонда Стратегического и Инновационного Развития Иркутской Области, 2024 год
Избранные публикации за последние 3 года
Обзоры
Sobenina L. N., Trofimov B. A. Recent strides in the transition metal-free cross-coupling of haloacetylenes with electron-rich heterocycles in solid media // Molecules. – 2020. – V. 25. – N. 11. – Article number 2490. DOI: 10.3390/molecules25112490
Иванов А.В., Щербакова В.С., Собенина Л.Н. Замещенные пирролы на основе кетонов: перспективы использования и достижения в синтезе // Успехи химии. 2023. – V. 92 (9), RCR5090
Собенина Л.Н., Томилин Д.Н. Синтез и перспективы применения мезо-CF3-флуорофоров BODIPY // Журнал Общей Химии. 2024. – V. 93. – P. – 143-172. DOI: 10.1134/S1070363223140050
Статьи
Saliy I.V., Gotsko M.D., Sobenina L.N., Ushakov I.A., Trofimov B.A. Bio-inspired functionalized pyrrole-pyridone ensembles: synthesis on the platform of acylethynylpyrroles // Synthesis. – 2020. – V. 52. – N. 18. – P. 2698-2704. DOI: 10.1055/s-0040-1707148.
Martynovskaya S.V., Shcherbakova V.S., Ushakov I.A., Borodina T.N., Ivanov A.V. Expedient synthesis of a new class of organic building blocks: N-allenylpyrrole-2-carbaldehydes // Tetrahedron Letters. – 2020. – V. 61. – 152666. DOI: 10.1016/j.tetlet.2020.152666.
Ivanov A.V., Martynovskaya S.V., Shcherbakova V.S., Ushakov I.A., Borodina T.N., Bobkov A.S., Vitkovskaya N.M. Ambient access to a new family of pyrrole-fused pyrazine nitrones via 2-carbonyl-N-allenylpyrroles // Org. Chem. Front. – 2020. – V. 7. – P. 4019 – 4025. DOI: 10.1039/D0QO00762E.
Vitkovskaya N.M., Bobkov A.S., Kuznetsova S.V., Shcherbakova V.S., Ivanov A.V. Base-promoted formation of annelated pyrrolo-1,4-oxazine ensemble from 1H-pyrrol-2-ylmethanol and propargyl chloride // ChemPlusChem. – 2020. – V.84. – P. 1 – 14. DOI: 10.1002/cplu.201900407.
Tomilin D.N., Sobenina L.N., Ushakov I.A., Trofimov B.A. Highly functionalized pyrrolylpyridines from 2-(acylethynyl)pyrroles // Synthesis. – 2021. – V. 53. – Iss. 6. – P. 1137-1148. DOI: 10.1055/s-0040-1706474.
Petrova O.V., Budaev A.B., Sagitova E.F., Ushakov I.A., Sobenina L.N., Ivanov A.V., Trofimov B.A. Pyrrole-aminopyrimidine ensembles: cycloaddition of guanidine to acylethynylpyrroles // Molecules. – 2021. – V. 26. – Iss. 6. – P. 1692 (1-16). DOI: 10.3390/molecules26061692.
Oparina L.A., Belyaeva K.V., Koluvanov N.A., Ushakov I.A., Gotsko M.D., Sobenina L.N., Vashchenko A.V., Trofimov B.A. Catalyst-free annulation of acylethynylpyrroles with 1-pyrrolines: A straightforward access to tetrahydrodipyrrolo[1,2-a:1′,2′-c]imidazoles // Journal of organic chemistry. – 2022. – V. 87. – N. 15. – P. 9518-9531. DOI: 10.1021/acs.joc.2c00476.
Tomilin D.N., Sobenina L.N., Saliy I.V., Ushakov I.A., Belogolova A.M., Trofimov B.A. Substituted pyrrolyl-cyanopyridines on the platform of acylethynylpyrroles via their 1 : 2 annulation with acetonitrile under the action of lithium metal // New Journal of Chemistry. – 2022. – V. 46. – N. 27. – P. 13149-13155. DOI: 10.1039/D2NJ02011D.
Gotsko M.D., Saliy I.V., Sobenina L.N., Ushakov I.A., Trofimov B.A. Tosyl/pyrrolyl-capped 1,3-enynes via t-BuOK-assisted reaction of TosMIC with acylethynylpyrroles: a new feature of this popular reagent // New Journal of Chemistry. – 2022. – V. 46. – N. 35. – P. 16646-16650. DOI: 10.1039/D2NJ02827A.
Belyaeva K.V., Nikitina L.P., Gen’ V.S., Tomilin I.V., Sobenina L.N., Afonin A.V., Oparina L.A., Trofimov B.A. 1-Methylimidazole as organic catalyst for [3+3]-cyclodimerization of acylethynylpyrroles to bis(acylmethylidene)dipyrrolo[1,2-a:1',2'-d]pyrazines // Catalysts. – 2022. – V. 12. – N. 12. – Article number 1604. https://doi.org/10.3390/catal12121604.
Gotsko M.D., Saliy I.V., Ushakov I.A., Sobenina L.N., Trofimov B.A. Substituent-dependent divergent synthesis of 2-(3-amino-2,4-dicyanophenyl)pyrroles, pyrrolyldienols and 3-amino-1-acylethylidene-2-cyanopyrrolizines via reaction of acylethynylpyrroles with malononitrile // Molecules. – 2022. – V. 27. – 8528. https://doi.org/10.3390/molecules27238528.
Martynovskaya S.V., Budaev A.B., Ushakov I.A., Borodina T.N., Ivanov A.V. Solvent moisture-controlled self-assembly of fused benzoimidazopyrrolopyrazines with different ring’s interposition // Molecules. – 2022. – V. 27. – 2460. DOI: 10.3390/molecules27082460.
Denis N. Tomilin, Sophia A. Stepanova, Lyubov N. Sobenina, Igor A. Ushakov and Boris A. Trofimov Acylmethylidenepyrrolo[1,2-c]oxazoles via [3+2]-cyclization of 2-acylethynylpyrroles with carbonyl compounds // New J. Chem. – 2023. – 47. – DOI: 10.1039/d3nj03142j.
Ivanov A.V., Bobkov A.S., Martynovskaya S.V., Budaev A.B., Vitkovskaya N.M. A Short-Cut to Substituted Fused Pyrrolo[2,1-c][1,4]oxazines: A Hybrid Theoretical and Experimental Study // Asian J. Org. Chem. – 2023. – e202300153
Trofimov B.A., Sobenina L.N., Petrova O.V., Sagitova E.F., Petrushenko K.B., Tomilin D.N., Martyanova E.G., Razumov V.F., Oparina L.A., Ushakov I.A., Korchagin D.V., Belogolova A.M., Trofimov A.B. Macrocyclic bridgehead fluorophores, pyrrolyl-diazabicyclo [8.3.1]-tetradecadienones, with giant stokes shifts // Journal of organic chemistry.– 2024.– 89.– 24.– 18142–18158. DOI: 10.1021/acs.joc.4c02002
Martynovskaya S.V., Gyrgenova E.A., Ushakov I.A., Borodina T.N., Ivanov A.V. Synthesis of Tetrazines from N-Allenylpyrrole-2-carbaldehydes and pH-Controlled Reversible Fragmentation // Organic Letters. – – V. 26, 132. DOI: 10.1021/acs.orglett.3c03751