
Кадровый состав сотрудников группы
Храпова Ксения Олеговна – к.х.н., с.н.с.
Тележкин Антон Алексеевич – к.х.н., с.н.с.
Верхотурова Светлана Ильясовна – к.х.н., с.н.с.
Арбузова Светлана Николаевна – к.х.н., с.н.с.
Вый Екатерина Михайловна – лаборант.
Сат Айыран Орланович – лаборант.
Направление (область) научных исследований и тематика лаборатории/группы
Базовым направлением работы группы служит создание оригинальной концепции использования функциональных ацетиленовых кетонов в качестве удобной и эффективной синтетической платформы для получения разнообразных, в том числе гетероатомных, функционализированных карбо- и гетероциклических систем. В основе методологии лежит применение в качестве структурной базы аминоацетиленовых кетонов, легко получаемых по реакции хемоселективного окислительного кросс-сочетания пропаргиламинов (синтезируемых по реакции аза-Фаворского из кетиминов и газообразного ацетилена) с цилкоалифатическими, ароматическими и гетероароматическими ацилхлоридами с использованием каталитической системы PdCl2/Ph3P/CuI/Et3N. Целью научно-исследовательской работы группы являются систематические исследования реакционной способности получаемых электронодефицитных ацетиленов в реакциях с различными, в том числе фосфорцентрированными, нуклеофилами.
Основные научные результаты (фундаментальные исследования)
1.Синтез аминоацетиленовых кетонов из пропаргиламинов и ацилхлоридов
В рамках научно-исследовательской работы группы был предложен оригинальный метод синтеза малоизученного класса электронодефицитных ацетиленов реакцией хемоселективного кросс-сочетания пропаргиламинов с ацилхлоридами в присутствии системы PdCl2/Ph3P/CuI/Et3N. Показано, что процесс успешно реализуется при небольшом нагревании (40–45 °C) в среде толуола в течение 2–3 ч хемоселективно с образованием соответствующих аминоацетиленовых кетонов с препаративным выходом 77–97%.
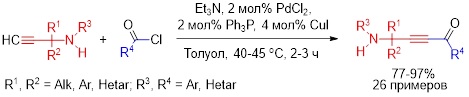
Неожиданным оказался факт инертности аминогруппы к реакции ацилирования как в условиях проведения процесса, так и при использовании трехкратного мольного избытка ацилхлорида.
Исходные пропаргиламины были получены оригинальной реакцией нуклеофильного присоединения газообразного ацетилена к кетиминам разнообразного строения с использованием суперосновной системы t-BuOK/ДМСО [Schmidt E.Yu., Bidusenko I.A., Protsuk N.I., Demyanov Y.V., Ushakov I.A., Trofimov B.A. Superbase-Promoted Addition of Acetylene Gas to the C=N Bond // Eur. J. Org. Chem. – 2019. – P. 5875–5881].
Volkov P.A., Khrapova K.O., Bidusenko I.A., Telezhkin A.A., Schmidt E.Yu., Albanov A.I., Trofimov B.A. Chemoselective cross-coupling of terminal propargylamines with (het)aroyl chlorides: synthesis of β-aminoacetylenic ketones bearing aromatic and heteroaromatic substituents // Russ. Chem. Bull. – 2022. – V. 71. – Р. 1514–1518. DOI: 10.1007/s11172-022-3558-3.
Volkov P.A., Khrapova K.O., Telezhkin A.A., Bidusenko I.A., Schmidt E.Yu., Albanov A.I., Trofimov B.A. Pd/Cu-Catalyzed Cross-Coupling of Densely Substituted Propargylamines with Aromatic Acyl Chlorides Followed by the Treatment with a Base: Access to Dihydro-3H-Pyrrol-3-Ones // Adv. Synth. Catal. – 2023. – V. 365. – P. 53–67. DOI: 10.1002/adsc.202201179.
2. Основно-каталитическая тандемная сборка 1,2-дигидро-3H-пиррол-3-онов из аминоацетиленовых кетонов
На основе оригинальной основно-каталитической реакции внутримолекулярной циклизации новой группы аминоацетиленовых кетонов разработана стратегия направленного синтеза 1,2-дигидро-3H-пиррол-3-онов – фармацевтически, синтетически и технически ценных и перспективных субстанций и строительных блоков. В качестве основных катализаторов были использованы KOH и Et2NH. Процесс реализуется в среде этанола при 40–55 °С в течение 8–17 ч, выходы целевых пирролонов достигают 92%.
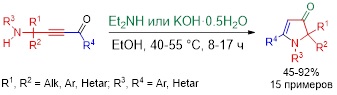
Схема тандемной сборки 1,2-дигидро-3H-пиррол-3-онов включает первоначальное присоединение молекулы воды в присутствии КОН с образованием енолов А, которые далее подвергаются перегруппировке в соответствующие 1,3-дикетоны В. Дальнейшая внутримолекулярная нуклеофильная атака аминогруппы по карбонильному фрагменту приводит к образованию промежуточных гидроксипирролидинонов C, которые после отщепления молекулы воды образуют целевые 1,2-дигидро-3H-пиррол-3-оны.
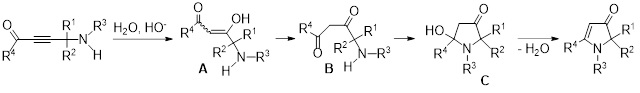
Volkov P.A., Khrapova K.O., Telezhkin A.A., Bidusenko I.A., Schmidt E.Yu., Albanov A.I., Trofimov B.A. Pd/Cu-Catalyzed Cross-Coupling of Densely Substituted Propargylamines with Aromatic Acyl Chlorides Followed by the Treatment with a Base: Access to Dihydro-3H-Pyrrol-3-Ones // Adv. Synth. Catal. – 2023. – V. 365. – P. 53–67. DOI: 10.1002/adsc.202201179.
3. Направленный синтез 1,2-дигидро-3H-пиррол-3-тионов на основе пропаргиламинов и ацилхлоридов
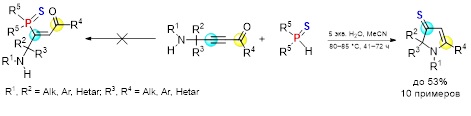
Открыта эффективная однореакторная стратегия синтеза 1,2-дигидро-3H-пиррол-3-тионов (практически неизвестных гетероциклических систем) на основе пропаргиламинов, ацилхлоридов и сульфида натрия. Целевая сборка включает первоначальное смешение пропаргиламина с ацилхлоридом в присутствии каталитической системы PdCl2/CuI/Ph3P (соотношение 2:4:2 моль%) в комбинированном растворителе Et3N/толуол при 40–45 °C в течение 3 ч с последующим добавлением к полученной реакционной смеси этанола и 2 эквивалентов Na2S∙9H2O и проведением процесса при 20–25 °С в течение 7 ч. Препаративный выход целевых функциональных гетероциклов достигает 91%.

Показана принципиальная возможность применения в качестве стартового реагента элементной серы. Реакция включает первоначальное расщепление молекулы серы под действием гидроксида калия при 50–55 °С в течение 4 ч в растворе этанола и дальнейшее введение в реакционную смесь аминоацетиленового кетона. Выходы дигидро-3H-пиррол-3-тионов составляют 59–75%.
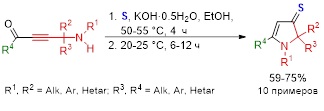
Volkov P.A., Khrapova K.O., Vyi E.M., Telezhkin A.A., Bidusenko I.A., Albanov A.I., Schmidt E.Yu., Trofimov B.A. Dihydropyrrole-3-thiones: one-pot synthesis from propargylamines, acyl chlorides and sodium sulfide // Org. Biomol. Chem. – 2023. – V. 21. – P. 6903–6913. DOI: 10.1039/d3ob01061a.
Volkov P.A., Khrapova K.O., Vyi E.M., Telezhkin A.A., Bidusenko I.A., Albanov A.I., Shchepochkin A.V. Elemental sulfur as a trigger and reagent in cyclization of γ-aminoacetylenic ketones to 1,2-dihydro-3H-pyrrole-3-thiones // Mendeleev Commun. – 2025. – V. 35. – P. 102–104. DOI: 10.71267/mencom.7582.
4. Реакции вторичных фосфинхалькогенидов с аминоацетиленовыми кетонами
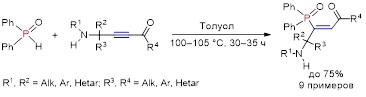
В рамках дальнейшего изучения синтетического потенциала аминоацетиленовых кетонов реализовано простое хемо-, регио- и стереоселективное присоединение дифенилфосфиноксида к аминоацетиленовым кетонам, 1,4-диорганил-(4-органиламино)алк-2-ин-1-онам, обеспечивающее эффективный синтез с выходом до 75% ранее неизвестной группы сложных полифункциональных молекул, Z-3-(дифенилфосфорил)-1,4-диорганил-4-(органиламино)алк-2-ен-1-онов, перспективных объектов для тонкого органического синтеза и фармакологических исследований. Реакция протекает при нагревании некаталитических условиях в среде толуола при 100–105 °С в течение 30–35 ч.
Обнаружен неожиданный факт переноса атома серы от молекулы вторичных фосфинсульфидов на тройную связь аминоацетиленовых кетонов, приводящего к синтезу 1,2-дигидро-3H-пиррол-3-тионов. Реакция реализуется в среде ацетонитрила при 80–85 °С в течение 41–72 ч с образованием целевых функциональных гетероциклических соединений с препаративным выходом до 53%. При этом продукты простого нуклеофильного присоединения вторичного фосфинсульфида к тройной связи электронодефицитного ацетилена образуются в следовых количествах.
Разработан удобный подход к стабильным замещенным 1,2-дигидро-3Н-пиррол-3-селонам, полученным в результате легкого переноса атома селена от вторичных фосфинселенидов к доступным аминоацетиленовым кетонам, синтезируемым оригинальным методом на основе пропаргиламинов и ацилхлоридов. Обнаруженная реакция открывает простой и прямой путь к новому семейству стабильных селонов, дополняющих, таким образом, ограниченный набор гетероциклов, содержащих двойные C=Se связи. Кардинальным отличием от известных ранее соединений является одновременное объединение в одной молекуле селоновой функции с жизненно важной пиррольной системой. Полученные данные способствуют лучшему пониманию электронной природы связи C=Se и закономерностей, определяющих ее стабильность.
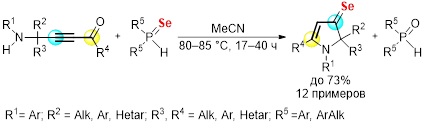
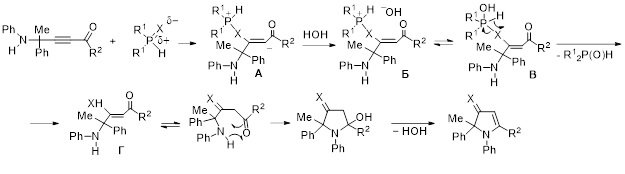
Схема образования 1,2-дигидро-3H-пиррол-3-тионов и -селонов, вероятно, включает нуклеофильное присоединение вторичного фосфинсульфида или фосфинселенида к тройной связи ацилацетилена (с участием атома халькогена, несущего частичный отрицательный заряд). Карбанионный центр образующегося при этом цвиттер-иона А нейтрализуется протоном воды, а возникающий гидроксид-анион атакует атом фосфора в катионе фосфония Б с образованием функционализированного фосфорана В. Одновременное расщепление связи фосфор-халькоген и формирование связи халькоген-водород приводит к образованию соответствующего вторичного фосфиноксида и винилтиола или винилселенола Г, который далее прототропно изомеризуется в соответствующий тион или селон. Внутримолекулярное нуклеофильное присоединение аминогруппы к карбонильной группе приводит к замыканию гидроксипирролидинового цикла. Отщепление молекулы воды с образованием двойной связи завершает процесс образования целевого пирролтиона или -селона.
Verkhoturova S.I., Volkov P.A., Bidusenko I.A., Arbuzova S.N., Zinchenko S.V., Trofimov B.A. Chemo-, regio-, and stereoselective catalyst-free addition of diphenylphosphine oxide to acetylenic amino ketones. Synthesis of Z-diphenylphosphoryl(organylamino)alkenones // Russ. Chem. Bull. – 2024. – Vol. 73. – No. 6. – P. 1738–1744. DOI: 10.1007/s11172-024-4291-x.
Volkov P.A., Verkhoturova S.V., Arbuzova S.N., Khrapova K.O., Bidusenko I.A., Zinchenko S.V., Trofimov B.A. Extraordinary sulfur/oxygen exchange between P=S and C=O bonds during the reaction of γ-aminoacetylenic ketones with secondary phosphine sulfides // Mendeleev Commun. – 2025. – V. 35. – P. 158–161. DOI: 10.71267/mencom.7627.
Volkov P., Verkhoturova S., Khrapova K., Arbuzova S., Bidusenko I., Albanov A., Trofimov B. Selenium transfer from secondary phosphine selenides to aminoacetylenic ketones: access to 1,2-dihydro-3H-pyrrole-3-selones with a stable C=Se bond // Org. Lett. – 2024. – V. 26. – N. 35. – P. 7336–7340. DOI: 10.1021/acs.orglett.4c02491.
5. Некаталитическое региоспецифическое SNHAr фосфинилирование пиридинов Н-фосфинатами, инициируемое бензоилфенилацетиленом
Недавно [Trofimov B.A., Volkov P.A., Telezhkin A.A. Electron-Deficient Acetylenes as Three-Modal Adjuvants in SNH Reaction of Pyridinoids with Phosphorus Nucleophiles // Molecules. – 2021. – V. 26. – P. 6824. DOI: 10.3390/molecules26226824] нами был открыт новый тип SNHAr реакции азинов с фосфинхалькогенидами, новизна которого обусловлена использованием электронодефицитных ацетиленов в качестве триггеров/окислителей. Данную реакцию отличает также достаточно широкий субстратный охват азинов (пиридины, хинолины, изохинолины, акридины, фенантридины), фосфинхалькогенидов (оксиды, сульфиды, селениды) и электронодефицитных ацетиленов (алкилпропиолаты, терминальные и интернальные ацилацетилены, фенилцианоацетилен).
В продолжение этих исследований данная методология функционализации пиридиноидов была расширена на такой родственный вторичным фосфинхалькогенидам тип РН-нуклеофилов как эфиры Н-фосфиновых кислот. Эксперименты показали, что оптимальным для взаимодействия пиридина и его замещенных с производными Н-фосфинатов и бензоилфенилацетиленом является нагревание смеси до 50 °С без растворителя в течение 26–238 ч с образованием соответствующих 4-фосфинилпиридинов с препаративным выходом до 68%.

Механизм кросс-сочетания, вероятно, включает обратимое формирование 1,3(4)-диполя (интермедиат А) в результате нуклеофильной атаки атома азота пиридина на тройную связь ацилацетилена. Карбанионный центр интермедиата А нейтрализуется протоном фосфината с формированием промежуточной ионной пары Б. Однако, в отличие от аналогичной реакции с участием фосфинхалькогенидов, в реакционной смеси не было обнаружено ожидаемых N-бензоилэтенил-C-фосфинилированных дигидропиридинов В. Предположительно, вместо их формирования происходит окислительное элиминирование халкона от пиридиниевого катиона ионной пары Б. В этом случае бензоилэтенильный фрагмент, вероятно, отщепляется в виде аниона с одновременным отщеплением протона из положения 2 пиридинового кольца. В результате образуется новая ионная пара Г, которая далее путем 1,3-гидридного сдвига превращается в целевые продукты реакции.
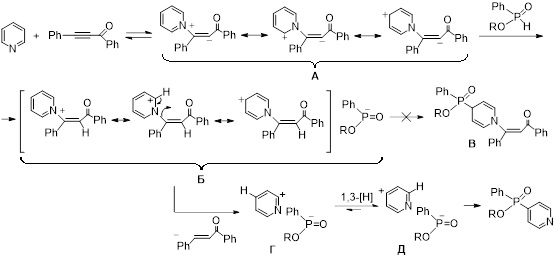
Khrapova K.O., Volkov P.A., Telezhkin A.A., Albanov A.I., Chupakhin O.N., Trofimov B.A., Catalyst- and solvent-free regiospecific SNHAr phosphinylation of pyridines with H-phosphinates mediated by benzoylphenylacetylene // Org. Biomol. Chem. – 2024. – V. 22. – N. 26. – P. 5419–5427. DOI: 10.1039/D4OB00661E.
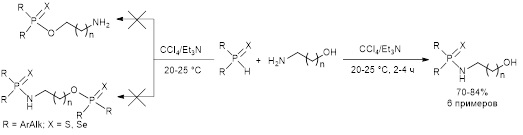
6. Окислительное кросс-сочетание вторичных фосфинхалькогенидов с аминоспиртами и аминофенолами
Были получены новые данные по изучению реакций окислительного кросс-сочетания вторичных фосфинхалькогенидов с таким новым типом реагентов, как аминоспирты и аминофенолы. Исследования показали, что реакция с участием аминоспиртов протекает в мягких условиях (20–25 °С, 2–4 ч) в присутствии системы CCl4/Et3N с хемоселективным образованием амидов халькогенофосфиновых кислот с выходом 70–84%.
В противоположность аминоспиртам аминофенолы в аналогичных условиях реагируют с вторичными фосфинхалькогенидами с образованием исключительно эфиров халькогенофосфиновых кислот с препаративным выходом 70–84%.
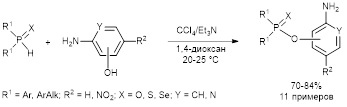

Khrapova K.O., Telezhkin A.A., Volkov P.A., Larina L.I., Pavlov D.V., Gusarova N.K., Trofimov B.A. Oxidative cross-coupling of secondary phosphine chalcogenides with amino alcohols and aminophenols: aspects of the reaction chemoselectivity // Org. Biomol. Chem. – 2021. – V. 19. – P. 5098–5107. DOI: 10.1039/d1ob00287b.
Гранты, контракты, хоздоговора, партнеры по инновационным исследованиям за последние 5 лет
MK-5606.2021.1.3 победитель “Конкурса 2021 года на право получения грантов Президента Российской Федерации для государственной поддержки молодых российских ученых – кандидатов наук” к.х.н. Храпова Ксения Олеговна
РНФ 18-73-10080P ««Электрофильные ацетилены как триггеры и окислители в SNHAr-реакциях азинов с РН-нуклеофилами: развитие химии фосфорилированных азинов» (руководитель – к.х.н. П.А. Волков)
РНФ 25-23-00146 «Синтез и изучение нового класса соединений с устойчивыми связями C=Se – дигидропирролселонов на основе ацетилена, иминов и элементного селена» (руководитель – д.х.н. П.А. Волков)
Обзоры
Trofimov B.A., Volkov P.A., Telezhkin A.A. Electron-Deficient Acetylenes as Three-Modal Adjuvants in SNH Reaction of Pyridinoids with Phosphorus Nucleophiles // Molecules. – 2021. – V. 26. – P. 6824. DOI: 10.3390/molecules26226824.
Тележкин А.А., Волков П.А., Храпова К.О. Нуклеофильное замещение водорода в пиридине и его производных фосфорорганическими нуклеофилами в присутствии электронодефицитных ацетиленов // Журнал органической химии. – 2023. – Т. 59. – N 10. – С. 1269–1300. DOI: 10.31857/S0514749223100026.














